


国内首个新冠口服药VV116有望下半年申请上市
17日获悉,国内唯一获批进入临床试验的新冠治疗小分子药物VV116,年内通过临床试验后,将第一时间启动上市申请。临床前药效学研究显示,VV116在体外对新冠病毒原始病毒株和变异株,例如德尔塔病毒等都有显著的抑制活性作用。企业评估预计于2022年下半年递交上市申请,国内上市申请正同步推进中。
正大天晴阿达木单抗生物类似药获批上市
1月20日,中国生物制药(1177.HK)宣布,旗下核心企业正大天晴生产的泰博维® (阿达木单抗注射液)正式获得国家药品监督管理局批准,用于类风湿关节炎、强直性脊柱炎、银屑病三大适应症的治疗。

国内
NMPA发布生物安全柜注册审查指导原则
19日,为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,根据《医疗器械注册与备案管理办法》,NMPA组织制定了生物安全柜注册审查指导原则等2项技术指导原则并予以发布。
河南省272家药品零售连锁企业进入集采
日前,河南医保局发布《关于相关药品零售连锁企业执行部分集中带量采购中选结果有关事项的通知》。《通知》表示,为方便群众购买集采药品,全省将纳入272家药品零售连锁企业执行集中带量采购,涉及9个集采批次,共有中选产品373个,包含阿莫西林、阿托伐他汀、布洛芬、利伐沙班片等多个知名药品。
CDE发布2则临床试验设计指导原则
20日,CDE连发2则通告,分别是《长效重组人粒细胞集落刺激因子预防化疗后中性粒细胞减少性发热临床试验设计指导原则(试行)》和《西妥昔单抗注射液生物类似药临床试验设计指导原则(试行)》,以鼓励新药研发,自发布之日起施行。
国外
5家中国药企获授权免费仿制默沙东口服新冠药
20日,日内瓦药品专利池组织宣布,已与27家仿制药企业签署协议,生产默沙东口服COVID-19抗病毒药物molnupiravir,将促进全球患者在可接受的负担下使用这款新冠口服药。中国有资格仿制的企业共有5家,包括复星医药、朗华制药、龙泽制药、博瑞医药、迪赛诺医药。
欧洲议会批准加强药品监管机构应对短缺的能力
近日,欧盟签署了一项临协议,以使欧洲药品管理局EMA更有效地解决药品和医疗器械的短缺问题。根据协议,EMA将建立和管理欧洲短缺检测平台,以促进收集医药产品的短缺、供应和需求信息。该机构还将建立一个公共网页,提供关键药品和医疗器械的短缺信息。
欧盟新临床试验系统将于月底上线
欧盟新临床试验信息系统(CTIS)将于 2022 年 1 月 31 日上线,届时欧盟临床试验的实施和监督将发生根本性转变,为临床试验法规(第 536/2014 号)的生效铺平道路。CTIS 由欧洲药品管理局(EMA)开发,旨在帮助实现 2014 年 4 月临床试验法规通过时所承诺的诸多好处,例如,协调临床试验申请的提交和评估,提交试验透明度。对于制药企业来说,CTIS 的推出会带来很多新的实践和运营考虑。

国内
凯赛生物聘任杨晨为公司副总裁
17日,凯赛生物发布公告称,董事会同意聘任杨晨为公司副总裁,任期自本次董事会审议通过之日起至第一届董事会任期届满之日止。
针对炎症性疾病 信达生物引进3款酶特异性抗体
18日,Amagma Therapeutics宣布,与信达生物达成了一项许可选择协议,开发最多3款酶特异性抑制剂。根据协议条款,信达生物获得在大中华区开发和商业化最多3款选择药物的独家权益,而Amagma则保留在中国以外的所有权益。同时,如果信达生物行使选择权,Amagma有资格获得相应的开发、批准和商业里程碑付款,以及特权使用费。
陈康伟将任阿斯利康中国肿瘤事业部总经理
20日,阿斯利康宣布,自2022年3月1日起,现任阿斯利康中国台湾地区总经理陈康伟将被任命为阿斯利康中国肿瘤事业部总经理,全面负责阿斯利康中国市场肿瘤业务。
小核酸研究所拟无偿划转泽璟制药股份至昆山工研院
21日,泽璟制药发布公告称,公司国有股东小核酸研究所拟将其持有的公司2.88%股份无偿划转至昆山工研院。小核酸研究所系昆山工研院的下属国有全资子公司。
恒瑞创新药卡瑞利珠单抗研究成果登上柳叶刀子刊
近日,由郑州大学第一附属医院樊青霞教授和王峰教授牵头开展的卡瑞利珠单抗联合阿帕替尼二线治疗晚期食管鳞癌的多中心Ⅱ期临床研究(CAP 02研究)重磅结果发表于《柳叶刀·胃肠病和肝病学》杂志,该研究引发学界关注。据恒瑞医药中央医学事务部侯志国介绍,卡瑞利珠单抗用于可切除食管癌的辅助治疗和新辅助治疗,用于不可切除局晚期食管癌的围术期免疫联合治疗等等探索都已经在全面开展当中。
国外
科济药业任命Richard John Daly为旗下美国公司总裁
17日,科济药业发布公告称,委任Richard John Daly为其旗下美国公司CARsgen Therapeutics Corporation总裁,向科济药业创始人、董事会主席、首席执行官、首席科学官李宗海博士汇报。
葛兰素史克首席科学官Hal Barron将加入Altos Labs
19日获悉,Hal Barron将于8月正式卸任葛兰素史克首席科学官职务,领导湾区初创公司Altos Labs。Barron将继续担任葛兰素史克董事会成员,为公司的研发计划提供指导。前辉瑞高管Tony Wood届时将接任CSO一职。

国内
联合利华收购葛兰素史克消费者保健业务遭拒绝
日前,葛兰素史克确认已拒绝联合利华主动提出的三项有条件且不具约束力的、针对GSK消费者保健业务的收购提议,这也意味着联合利华收购葛兰素史克消费医疗保健业务正式宣告失败。
和誉医药与礼来达成超2.5亿美元合作
1月18日,和誉医药宣布其已与礼来订立一份全球合作及独家许可协议,以进一步针对心脏代谢疾病等未被满足医疗需求的重大疾病中的未公开靶点,在新型小分子药物的发现、开发及潜在商业化领域开展合作。据悉,如果和誉医药成功将化合物推进至协定的终点,则礼来将有权进一步开发及商业化。若礼来负责临床开发及商业化,则和誉医药有权根据预定的临床前、临床开发及商业里程碑的成果,收取最多2.58亿美元的潜在费用,以及因该协议产生的销售分级特许权使用费。
塞力医疗子公司签订1.27亿元新冠检测试剂盒合同
21日,塞力医疗发布公告称,其全资子公司塞力斯生物技术于2022年1月20日与Ateş Gold Kuyumculuk签署《销售合作伙伴协议》,Ateş Gold Kuyumculuk 首期向生物技术采购2,000万美元其自主研发生产的新冠检测试剂盒,合总金额约人民币126,854,000元。首批试用订单金额为100万美元,目前对方已支付10万美元订金。
国外
卫材与ROIVANT签署试验性抗癌药独家许可协议
18日,卫材宣布,公司近日已与Roivant Sciences Ltd.一家子公司签订许可协议,独家授予Roivant试验性抗癌药H3B-8800的全球研究、开发、生产和销售权。根据协议条款,卫材将获得H3B-8800的合同预付款、开发和注册里程碑付款,上市后还将根据H3B-8800的销售收入,获得特定比例的特许权使用费。
礼来与Evotec签订10亿美元合作
近日,礼来与Evotec SE联合宣布,双方已在代谢性疾病领域达成一项药物发现合作,重点关注肾脏病和糖尿病。该合作最初为期3年。除了一笔未披露的预付款外,针对每个项目,Evotec还将有资格获得基于成功的发现开发、监管和商业里程碑付款,最高可达1.8亿美元,以及基于合作产生的任何产品净销售额的分层版税,潜在总价值最高可达10亿美元。
优时比将收购Zogenix
19日,优时比联合Zogenix宣布,双方已经达成一项最终协议,根据协议,优时比将收购Zogenix,本次交易总额最高达约19亿美元。
Sema4以6.23亿美元收购GeneDx
近日,Sema4表示,将以约6.23亿美元从Opko Health收购GeneDx,预计交易将在第二季度完成。根据收购条款,Sema4将向GeneDx支付1.5亿美元的预付现金以及其8000万股股票。在未来两年内,将向GeneDx额外支付高达1.5亿美元的基于收入的里程碑付款。

国内
强生FcRn抗体拟纳入突破性治疗品种
CDE官网公示显示,强生申报的1类新药nipocalimab注射液拟被纳入突破性治疗品种,针对的适应症为全身型重症肌无力。公开资料显示,nipocalimab是一款在研的抗FcRn抗体。
华海药业HB0036注射液临床试验获FDA批准
17日,华海药业发布公告称,HB0036注射液临床试验申请获得FDA批准。HB0036能同时高特异性的与PD-L1和TIGIT这两个靶点结合、阻断二者介导的免疫抑制,重新激活免疫系统对肿瘤细胞的杀伤,最终实现协同抗肿瘤作用。
恒瑞医药阿得贝利单抗申报上市
19日,CDE官网显示,恒瑞医药的PD-L1单抗阿得贝利单抗上市申请获受理。这是国产第5款申报上市的PD-L1单抗。
华北制药1类新药奥木替韦单抗即将获批
19日,NMPA官网显示,华北制药1类新药奥木替韦单抗已经进入在审批阶段,预计将在近日获批,用于狂犬病毒暴露患者的被动免疫。
之江生物四款新冠检测试剂盒获欧盟CE认证
19日,之江生物发布公告称,公司产品新型冠状病毒抗原检测试剂盒(胶体金法)、新型冠状病毒中和抗体检测试剂盒(ELISA)、新型冠状病毒中和抗体检测试剂盒(胶体金法)、新型冠状病毒(SARS-CoV-2)L452R &P681R 突变检测试剂盒于近期获得四项欧盟CE认证,有效期到2025年5月26日。
国外
塞力医疗新型杆状病毒抗原试剂盒取得欧盟CE认证
17日,塞力医疗在互动平台表示,公司自主研发的新型杆状病毒(COVID-19)抗原试剂盒(胶体金)目前已经取得欧盟CE认证,可在欧盟市场销售。同时,公司新型冠状病毒抗原检测试剂盒也在做申请美国FDA紧急使用授权的准备工作。
阿斯利康/第一三共药物Enhertu获FDA优先审评资格
17日,阿斯利康和第一三共宣布已收到美国FDA接受其抗体偶联药物Enhertu补充生物制品许可申请的通知,用于既往接受过抗HER2治疗方案的不可切除或转移性HER2阳性乳腺癌成人患者的治疗。该sBLA申请也获得了优先审评资格,PDUFA日期为2022年的第二季度。
Olumiant和sotrovimab获得世卫组织推荐治疗新冠
近日,WHO推荐2款新的药物用于治疗COVID-19:1.礼来JAK抑制剂Olumiant(baricitinib,巴瑞替尼),被推荐用于治疗COVID-19重症患者,建议与皮质类固醇联合用药;2.葛兰素史克/Vir的单抗药物sotrovimab,被有条件推荐用于治疗有住院高风险的轻度或中度COVID-19患者。这包括年龄较大、免疫功能低下、患有糖尿病、高血压和肥胖症等基础疾病的患者以及未接种疫苗的患者。
阿斯利康与强生2款COVID-19疫苗存在风险
近日,欧洲药品管理局官网发布了其药物警戒风险评估委员会2022年1月10日至13日会议纪要。根据该纪要,PRAC建议,在2款COVID-19疫苗——阿斯利康Vaxzevria和强生COVID-19 Vaccine Janssen的产品信息中添加罕见的横贯性脊髓炎,以提高医疗专业人员和民众接种这2款疫苗后发生罕见TM病例的知晓率。TM还被添加作为一种频率未知的不良反应。PRAC审查了上述2款COVID-19疫苗全球报告病例的现有信息,包括欧洲药品不良事件报告数据库中的病例,以及来自科学文献的数据。PRAC得出结论称,这2款COVID-19疫苗与TM之间的因果关系至少存在合理的可能性。

国内
基石药业PDL1单抗III期临床达到总生存期研究终点
19日,基石药业宣布, 舒格利单抗注射液一线治疗转移性非小细胞肺癌的III期临床研究GEMSTONE-302达到总生存期的研究终点。结果显示,舒格利单抗联合化疗可显著延长患者的OS并具有临床意义。它是全球首个联合化疗显著改善鳞状和非鳞状IV期初治非小细胞肺癌患者总生存期的PD-L1单抗,OS等详细的研究数据将在近期召开的国际学术会议中公布。
复宏汉霖HLX208单药或联合治疗获批临床
18日,复星医药发布公告称,其控股子公司复宏汉霖收到NMPA关于同意靶向人类BRAF蛋白V600E突变小分子抑制剂HLX208单药或联合治疗晚期实体瘤开展临床试验的批准。
IL-2免疫刺激疗法在中国获批临床
18日,CDE公示显示,Nektar Therapeutics申报的IL-2免疫刺激疗法已获得临床试验默示许可,拟开发用于头颈部鳞状细胞癌。
辉瑞BCMA/CD3双抗在中国获批临床
CDE网站公示显示,辉瑞申报的elranatamab获得一项临床试验默示许可,拟用于以下适应症:单药或联合达雷妥尤单抗,用于既往接受过至少1线抗多发性骨髓瘤治疗的多发性骨髓瘤患者。公开资料显示,elranatamab是一款靶向BCMA和CD3的双特异性抗体药物,在全球已进入3期临床研究阶段。
科望医药抗CD39单抗在美1期临床完成首例患者给药
20日,科望医药宣布其在研创新抗体药物ES002在美国完成1期临床试验首例患者给药。公开资料显示,ES002为科望医药自主研发的抗CD39单克隆抗体。
国外
科霸生物原研单抗SPX-101在美启动I期临床试验
近日,科霸生物宣布在美国启动其单克隆抗体药物SPX-101的I期临床试验,主要探索SPX-101治疗晚期胰腺癌、胃癌、胆管癌、和卵巢癌病人的安全性和疗效。
华奥泰生物抗PD-L1/TIGIT双抗在美获批临床
18日,华海药业发布公告表示,美国FDA已批准其下属子公司华奥泰生物的HB0036注射液的临床试验申请。公开资料显示,HB0036由华奥泰生物自主研发,是一款靶向PD-L1和TIGIT的双特异性抗体。
iPSC衍生创新CAR-NK疗法临床申请获FDA批准
近日,Fate Therapeutics公司宣布,美国FDA已批准FT536的IND申请。这是一款经过多重工程修饰、诱导iPSC衍生的“即用型”嵌合抗原受体自然杀伤细胞疗法。
歌礼PD-L1单抗获FDA批准乙肝临床
17日,歌礼制药宣布皮下注射PD-L1抗体ASC22(恩沃利单抗)在美国的IND申请获批,用于慢性乙肝。
阿斯利康双重免疫组合疗法降低死亡风险22%
19日,阿斯利康宣布,重磅PD-L1抑制剂度伐利尤单抗与抗CTLA-4抗体tremelimumab联用,在一线治疗不可切除的肝细胞癌患者的3期临床试验中与活性对照相比,显著延长患者的总生存期。试验结果显示,接受这一给药方案治疗的患者,与活性对照组相比,死亡风险降低22%。中位总生存期为16.4个月,活性对照组为13.8个月。大约31%的患者在接受治疗3年后仍然活着,对照组这一数值为20%。Tremelimumab和Imfinzi组合的客观缓解率为20.1%,高于对照组的5.1%。
辉瑞Prevnar 20可与新冠mRNA疫苗同时接种
近日,辉瑞公布了一项3期临床研究的阳性顶线结果。该研究在美国570例年龄≥65岁的成人患者中开展,描述了沛儿20与COVID-19 mRNA疫苗Pfizer-BioNTech COVID-19 Vaccine同时接种、或每种疫苗与安慰剂同时接种的安全性和免疫原性。结果显示,当与一剂Pfizer-BioNTech COVID-19 Vaccine或安慰剂同时接种时,Prevnar 20针对所有20种血清型诱导的免疫应答相似。当与Prevnar 20或安慰剂同时接种时,加强剂量Pfizer-BioNTech COVID-19 Vaccine诱导的免疫应答也相似。Prevnar 20与加强剂量Pfizer-BioNTech COVID-19 Vaccine共同接种时的安全性概况反映了Pfizer-BioNTech COVID-19 Vaccine加强剂量的安全性。

药明康德2021年净利同比预增68%-70%
18日,药明康德发布业绩预告,预计2021年净利润增加20.13亿元-20.72亿元,同比增长68%-70%。整合后的化学业务板块,持续建设“一体化,端到端”CRDMO业务,订单需求旺盛,推动了全年销售收入加速增长;测试业务下实验室分析及测试业务和临床CRO/SMO 业务、生物学业务以及化学业务下小分子药物发现服务,也均继续保持了强劲的增长势头。小财注:Q3净利8.87亿元,据此计算,Q4净利预计14.11亿元-14.7亿元,环比增长59%-65%。
亚宝药业2021年净利同比预增54%-77%
18日,亚宝药业发布业绩预告,预计2021年实现归属于上市公司股东的净利润为1.65亿元到1.9亿元,同比增加53.68%到76.96%。2021年公司聚焦高毛利核心产品并加大推广力度,丁桂儿脐贴、消肿止痛贴、薏芽健脾凝胶及儿童清咽解热口服液等高毛利产品收入均取得较大增长;因为疫情影响,公司2020年净利润基数较小,使得本期业绩较上年同期增长幅度较大。
九洲药业2021年净利同比预增60%-80%
18日,九洲药业发布业绩预告,公司预计2021年度实现归属于上市公司股东的净利润为6.09亿元到6.85亿元,与上年同期相比,将增加2.28亿元到3.04亿元,同比增加60%到80%。
梅花生物2021年净利同比预增134%-144%
18日,梅花生物发布业绩预告,预计2021年净利润23亿元-24亿元,同比增加134%-144%。主要产品味精、苏氨酸、赖氨酸、黄原胶以及其他饲料氨基酸产品的售价上涨幅度远大于原材料价格增长幅度;处置子公司山西广生医药包装有限公司产生投资收益约2.7亿元左右。小财注:Q3净利3.23亿元,据此计算,Q4净利预计9.73亿元-10.73亿元,环比增长201%-232%。
海辰药业:2021年净利同比预增422.09%-441.30%
19日,海辰药业发布公告称,预计2021年度归属于上市公司股东的净利润2.88亿元-2.99亿元,同比增长422.09%-441.30%;归属于上市公司股东的扣除非经常性损益的净利润2652.13万元–3712.98万元,同比下降30%-50%。
济川药业:2021年净利同比预增30.31%
19日,济川药业发布业绩预告,预计2021年实现营业收入76.305亿元,较上年同期增长23.77%;归属于上市公司股东的净利润16.64亿元,较上年同期增长30.31%。基本每股收益1.87元。
九安医疗2021年净利同比预增271.40%-395.19%
19日,九安医疗发布公告称,预计2021年盈利9亿元-12亿元,比上年同期增长271.40%-395.19%。对于业绩增长原因,九安医疗表示,2021年度继续受全球新冠疫情影响,其新冠检测产品在美国市场销售业绩大幅度增长,促使2021年度经营业绩大幅度增长。

ImmPACT Bio完成1.11亿美元B轮融资
21日,美国ImmPACT Bio宣布已完成1.11亿美元的B轮融资。融资获得的资金将用于进一步推动公司开发基于逻辑回路的CAR-T细胞平台。
64x Bio完成5500万美元的A轮融资
19日,64x Bio宣布完成5500万美元的A轮融资。本轮融资由Lifeforce Capital领投,Northpond Ventures、个人投资者Michael Chambers、Future Ventures等参投。融资收益部分将用于支持64x Bio新型细胞系工程技术平台VectorSelect™的扩展,为各种不同的基因疗法设计改良的细胞系。
予果生物完成3亿元C轮融资
近日,予果生物宣布完成3亿元人民币的C轮融资,由上海生物医药基金独家领投,老股东LYFE洲嶺资本跟投。本轮募集资金将持续投入于新产品研发以及病原NGS的院内本地化部署。予果生物目前已经完成多轮股权融资,融资总额在行业内持续领先。

迈威生物登陆科创板 首日破发跌超29%
18日,迈威生物在上交所科创板上市,公司证券代码为688062,发行价格34.8元/股,募集资金将用于年产1,000kg抗体产业化建设项目、抗体药物研发项目、补充流动资金。截至晚间收盘,迈威生物报24.5元/股,跌幅29.6%,总市值97.9亿元。
华康医疗在创业板开始申购
19日,华康医疗在创业板上市开始申购,拟公开发行股票不超过2640万股,计划募集资金4.0443亿元,用于技术研发中心升级、营销及运维中心建设以及补充流动资金。
诚达药业登陆深交所创业板 首日涨幅超76%
20日,诚达药业登陆深交所创业板,公司代码为301201,本次发行价格为72.69元/股,预计募集资金总额为17.57亿元,扣除发行费用1.36亿元后,预计募集资金净额约为16.21亿元。截至今日收盘,报128.55元/股,涨幅76.85%,成交额18.08亿元,总市值124.3亿元。

中国生物医药行业进出口情况:出口额增幅明显
依据海关总署的披露口径来看,我国生物医药进出口产品相关的税则号如下表所示:

我国生物医药行业是国家重点支持的战略新兴产业,目前仍处于发展期,故对国外相关制品的进口依赖程度较高。2017-2020年,我国生物医药行业进口金额维持在100亿元以上,呈平稳增长态势;我国生物医药行业出口金额虽体量较小,但近年来增速较大,2017-2020年CAGR达到41.67%。
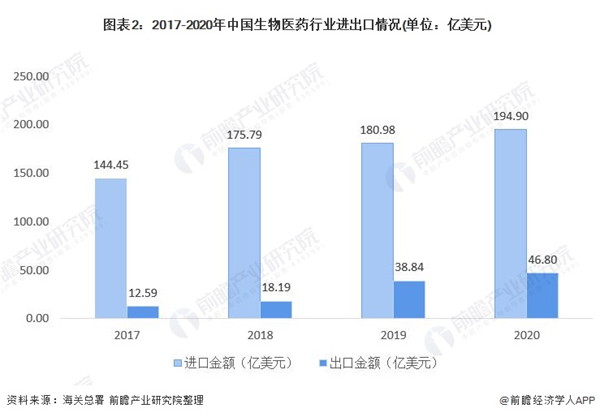
中国生物医药行业进出口仍处于贸易逆差状态
我国生物医药行业相关产品的进口额和出口额均呈增长态势,整体进出口总额亦增长明显。另,2017-2020年我国生物医药行业虽仍处于贸易逆差状态,但自2018年达到峰值后,贸易逆差有下降趋势,说明我国生物医药行业的自主研发生产能力正在逐渐增强。


| 2021-2026年国内外生物医药产业园建设运营状况与投资前景分析报告 |
| 2021-2026年中国生物医药行业市场前瞻与投资战略规划分析报告 |
| 2021年中国生物医药产业全景解析与招商策略建议研究报告 |
| 碳中和愿景下中国生物医药行业市场前瞻及绿色转型机遇研究分析报告 |
从学术到产业,更多定制化产业周刊(全球产业舆情监测、前沿技术情报追踪、产融政策权威解读、产业招商精准线索),敬请拨打400-068-7188。同时前瞻产业研究院还提供产业大数据、产业研究、产业链咨询、产业图谱、产业规划、园区规划、产业招商引资、IPO募投可研、IPO业务与技术撰写、IPO工作底稿咨询等解决方案。
未经允许不得转载:奥鸟视频-全球短视频资讯平台 » 前瞻生物医药产业全球周报2022第4期:国内首个新冠口服药有望下半年申请上市,正大天晴阿达木单抗生物药获批上市

 奥鸟视频-全球短视频资讯平台
奥鸟视频-全球短视频资讯平台









