胃肠间质瘤(Gastrointestinal stromal tumors,GISTs)是常见的人类肉瘤,常由 KIT 或血小板衍生生长因子 α(PDGFRα)突变引起[1]。约 80%的 GISTs 伴 KIT 突变,大多数具有 KIT 原发突变的 GISTs 对一线伊马替尼有效,但会因产生继发性突变而对一线治疗耐药[2]。可能是缺乏对 KIT 多重耐药突变的广泛覆盖,获批的二线、三线和四线药物(舒尼替尼、瑞戈非尼、瑞派替尼)仅显示出适度的临床获益,中位无进展生存时间仅为 4 - 6 个月,目前亟需一种耐受性好且可有效抑制多种 KIT 突变的药物[1]。
NB003 是新一代小分子抑制剂,可选择性靶向原发和继发 KIT/PDGFRα 耐药突变的 GIST[1]。P. Chi 等在 2023 年欧洲内科肿瘤学会(ESMO)大会汇报了 NB003 治疗晚期 GIST 患者的首次人体 I 期试验数据,结果显示在多线治疗的 GIST 患者中具有令人鼓舞的客观缓解率(ORR 为 15.8%)和疾病控制率(DCR 为 78.9%)[3]。
在今年的美国临床肿瘤学会(ASCO)年会上,北京大学肿瘤医院李健教授汇报了 NB003 治疗伊马替尼及其他 TKI 失败或不耐受的转移性 GIST 的 I 期研究剂量爬坡阶段数据[2],「丁香园肿瘤时间」特邀李健教授针对该研究结果接受专访,探讨标准治疗耐药或进展的晚期 GIST 患者诊疗进展。
GIST 面临耐药困境,亟待开发「新型」药物
相对而言,胃肠间质瘤是一个「小病种」,但随着诊断技术水平的提高,胃肠间质瘤的检出和诊断率大幅提升。近十年来,由于靶向治疗的兴起,靶向治疗联合手术治疗改善了 GIST 患者的生存获益。然而,靶向药物耐药以及耐药后继发基因突变是靶向治疗面临的主要挑战。目前,在后线治疗药物中,除瑞派替尼外,其他药物可能很难抑制住所有类型的 KIT 基因突变。
目前临床上亟需针对 GIST 多种不同类型基因突变的「新型」药物。李健教授团队开展的 NB003 治疗伊马替尼及其他 TKI 失败或不耐受的转移性 GIST 的 I 期研究则旨在解决上述临床困境。从药物设计到药物临床前的数据来看,NB003 符合「新型」药物的特征。
NB003「推陈出新」,多线多药经治人群仍有效
NB003 的「独特性」主要体现在针对 KIT/PDGFRα 突变的广泛抑制,KIT/PDGFRα 存在多种基因突变类型,特别是既往治疗耐药后会出现一些新的突变点,而且前线用的药物种类越多,诱导肿瘤出现的新的突变位点和类型就越多。通常来说,仅使用一种药物难以抑制多个突变位点。NB003 则对多个突变位点都有抑制作用,即使是后线治疗诱发出多个基因突变的情况下仍然有效,这一点在临床试验数据中得以体现。就李健教授团队主导的这项临床试验的入组人群而言,伊马替尼等标准治疗失败的患者是临床需求亟待满足的一类人群,尽管这些患者既往接受过多种药物治疗,但 NB003 治疗仍被证实在许多患者中具有疗效。
首次 Ⅰ 期人体试验,探索 7 个剂量水平
本次 ASCO 年会上公布了 NB003 首次人体 I 期研究的数据,该研究旨在评估 NB003 治疗伊马替尼和其他标准治疗(SoCs)后进展或不耐受的晚期 GIST 的安全性和耐受性(主要终点),同时也评估药代动力学(PK)、疗效和通过循环肿瘤 DNA(ctDNA)检测的突变状态(次要终点)。患者每日口服两次 NB003,采用加速滴定的贝叶斯最优区间(BOIN)设计,以期确定最大耐受剂量(MTD)或最大给药剂量(MAD)和推荐 Ⅱ 期剂量(RP2D)。
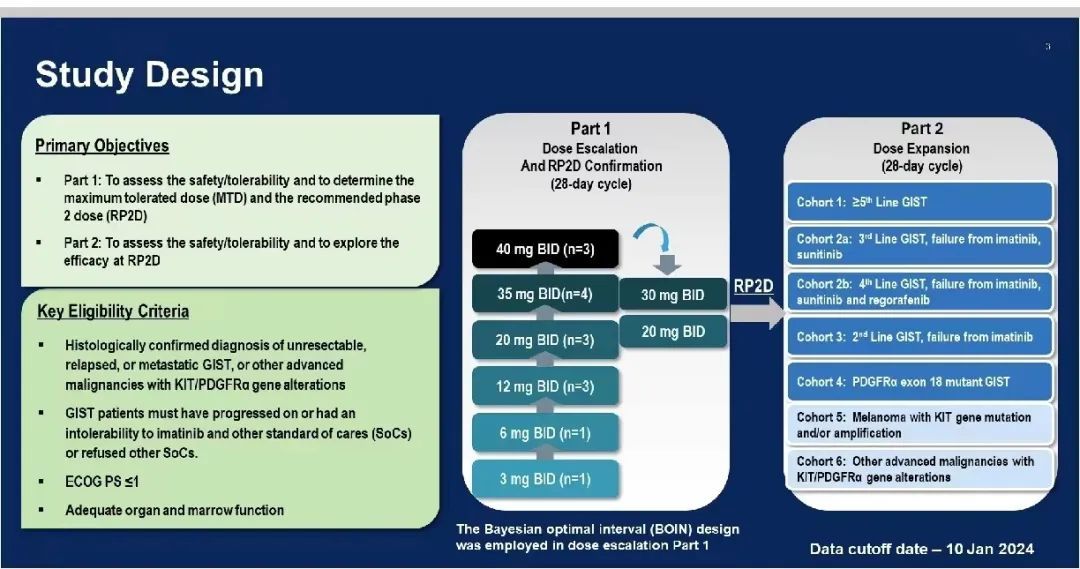
图 1.研究设计(来自讲者幻灯)
截至 2024 年 1 月 10 日,共 42 例患者在剂量递增阶段接受治疗,中位年龄 55 岁,69%为男性;71.4%为 ECOG PS 1 分,69%患者的主要突变为 KIT 外显子 11,TKI 治疗的中位线数为 4。本研究测试了七个剂量水平(DL),包括 3 mg(1 例)、6 mg(1 例)、12 mg(3 例)、20 mg(15 例)、30 mg(15 例)、35 mg(4 例)、40 mg(3 例)。
最常见的治疗相关不良事件(TRAEs)包括无症状肌酸激酶(CPK)升高(92.9%)、贫血(78.6%)、天冬氨酸转氨酶(AST)升高(76.2%)、面部水肿(76.2%)、白细胞计数减少(76.2%)、眼周水肿(66.7%)、中性粒细胞计数减少(64.3%)、淀粉酶升高(57.1%)、脂肪酶升高(52.4%)、血小板计数减少(45.2%)、外周水肿(38.1%)。最常见的 3 级及以上 TRAEs 包括贫血(61.9%)、无症状的 CPK 增加(59.5%)、中性粒细胞计数减少(23.8%)、白细胞计数减少(21.4%)。
各剂量组发生导致治疗中断的 TRAEs 及患者例数分别为:20 mg DL 组 2 例患者(衰弱、肿瘤出血);30 mg DL 组 2 例患者(AST 增加、白细胞计数减少);40 mg DL 组 1 例患者(面部水肿)。各组出现的剂量限制性毒性(DLTs)和患者例数分别为:40 mg DL 组 2 例患者(疲劳、面部水肿),30 mg DL 组 2 例患者(发热性中性粒细胞减少、斑丘疹、AST 增加)。
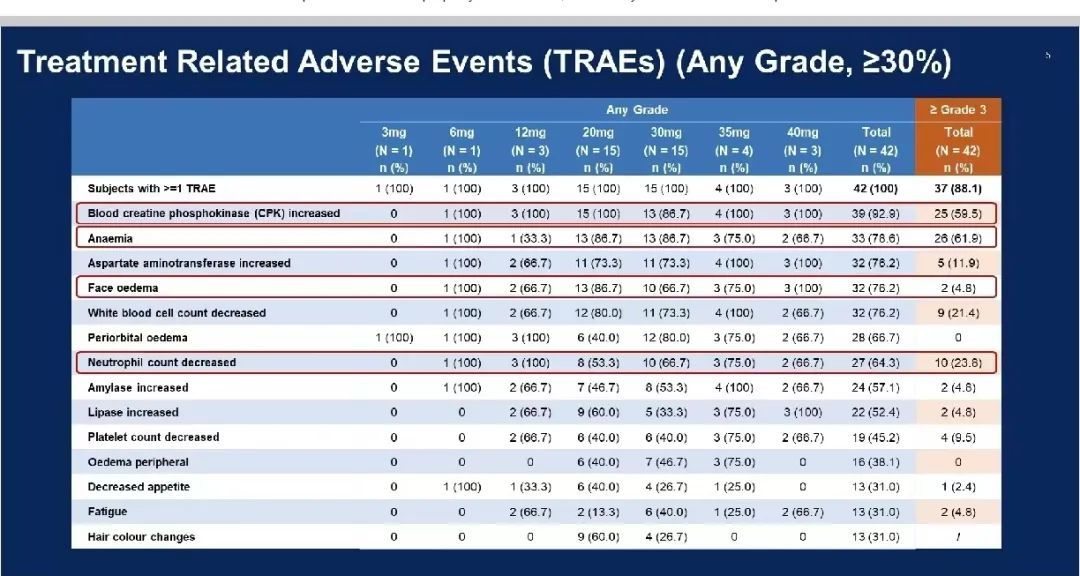
图 2.治疗相关不良事件
从目前披露的数据来看,NB003 的安全性较为可控。李健教授强调,「基于既往的胃肠间质瘤相关科研经验,在人群暴露较少的情况下,新药的试验数据往往不能完全暴露出其全面的不良反应谱。因此,在不良反应方面,我们仍需在后续的 Ia 期和 Ib 期试验中扩大人群,进行深入探索。」
NB003 对外显子 11、9 原发突变,外显子 13、17 继发突变GIST 疗效良好
李健教授提到,在胃肠间质瘤领域,既往中国研究多为桥接试验,而此次针对新药 NB003 的研究是中国和美国学者第一次共同合作开展的首次人体(first in human,FIH)试验。
在疗效方面,NB003 对外显子 11、9 原发突变 GIST 起到很好的效果,而既往药物治疗对外显子 9 突变的抑制并不是非常好。另外,外显子 17、13 继发突变是继发耐药的主要突变位点,一个是 ATP 活化环,一个是 ATP 的结合区,几乎很难有药物同时抑制这两个位点。目前的研究结果显示,NB003 针对上述两个位点的抑制均有效,且在临床试验中体现了其预期的疗效。
在 42 例接受治疗的患者中,研究者基于 mRECISTv1.1 进行评估,确认的 ORR 为 26.2%(11/42,95% CI:13.9, 42.0),DCR 为 73.8%(31/42,95% CI:58.0, 86.1)。
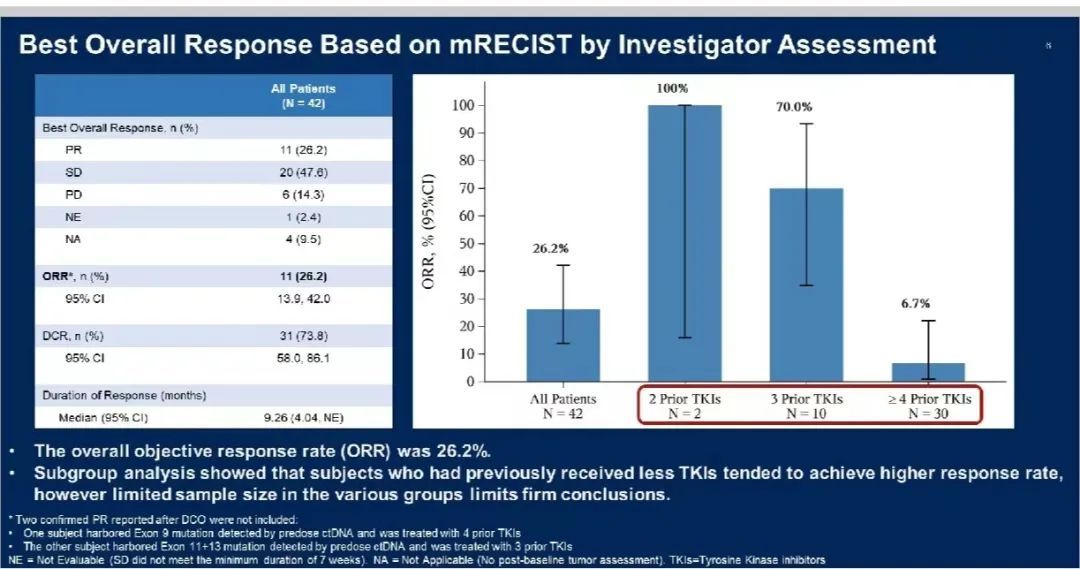
图 3.研究者评估的疗效(来自讲者幻灯)
大多数反应(7/11)仍在进行中。在给药前的 ctDNA 检测水平的基础上,KIT 激酶结构域的 ATP 结合位点和活化环中存在广泛的获得性耐药突变的患者表现出肿瘤缓解,包括 3 例外显子 11/13 突变,3 例外显子 11/17 突变,2 例外显子 17 突变,1 例外显子 16 突变,1 例外显子 9/17 突变,1 例未检测到突变。
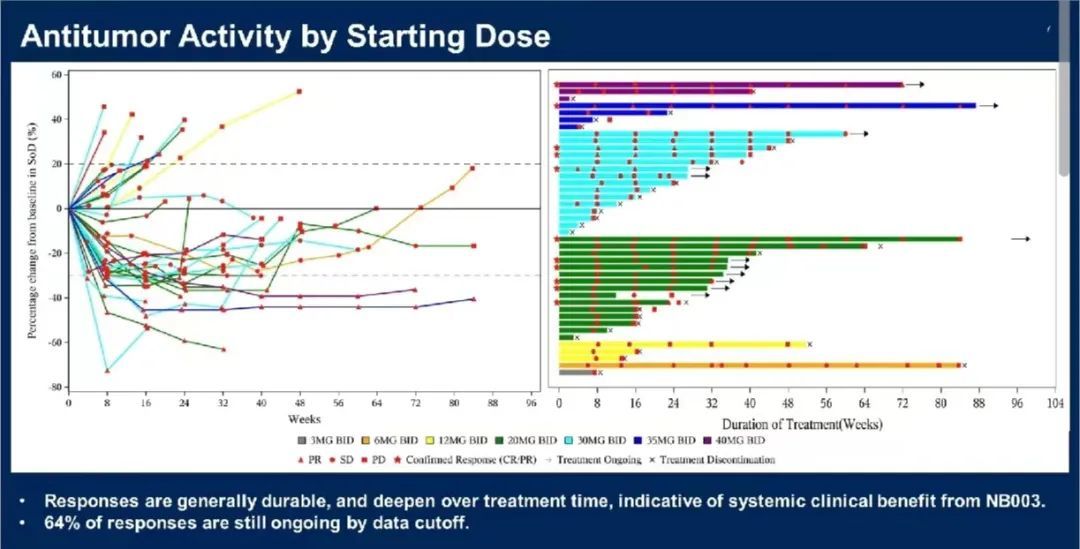
图 4.NB003 的抗肿瘤活性(来自讲者幻灯)
「好药早用」还是「末线解救」,仍待 Ib 期扩展队列数据
针对「2023 年 9 月美国食品药品监督管理局(FDA)授予 NB003 孤儿药资格认定」这一举措,李健教授表示,这意味着 NB003 疗效令人鼓舞,因此获得「快速开始临床试验」的认证。NB003 在 GIST 治疗的最终定位在哪里?是把它放在前线治疗,更好地发挥其作用,还是作为末线的解救治疗?李健教授提到,「我们需等待 Ib 期研究数据公布。Ib 期阶段,我们将会从二线、三线、四线、末线开展多个队列的探索,不同队列的数据出来后,我们会综合评估该药的疗效和安全性。原则上,若是好药,那么,未来将该药从末线推到更前线,包括二线,甚至一线治疗,将是值得关注的重要内容。一切都需要静待 Ib 期研究数据。」
总结与展望
NB003 对多线耐药的 GIST 有较好的疗效与可控的不良反应,研究者确认的 ORR 为 26.2%,DCR 为 73.8%。尤其是 ctDNA 检测显示无论是 ATP 结合区还是活化环的耐药突变,NB003 均有良好的抗肿瘤作用,有望成为多线标准治疗后耐药 GIST 的潜在治疗选择。目前,研究者正在招募 GIST 扩展队列,研究结果值得期待。
采访嘉宾

李健 教授
北京大学肿瘤医院消化肿瘤内科主任医师、博士生导师、行政副主任、药物临床试验机构副主任
CSCO 胃肠间质瘤专委会副主委
CSCO 临床研究专委会常委兼秘书长
CSCO 大肠癌专委会常委
中国医师协会外科分会胃肠间质瘤专委会副主委
中国医师协会 MDT 专委会常委兼青委主委
中国医师协会大肠癌专委会肝转移学组副主委
中国抗癌协会胃肠间质瘤专委会常委
中国抗癌协会肿瘤药物临床研究专委会常委兼副秘书长
中国抗癌协会大肠癌专委会委员及青委副主委
《中华结直肠疾病电子杂志》编委、《肿瘤临床与研究》编委
审校:李健教授
整理:暖暖;编辑:Bree
题图:图虫创意
未经允许不得转载:澳鸟-全球资讯平台 » 李健教授:晚期耐药 GIST 患者迎来新型 TKI|ASCO 2024

 澳鸟-全球资讯平台
澳鸟-全球资讯平台









