刚刚,国家药监局官网显示,渤健(Biogen)药物托夫生(Tofersen)在国内获批上市,用于治疗 SOD1 基因突变的成人肌萎缩侧索硬化症 (ALS),即渐冻症。
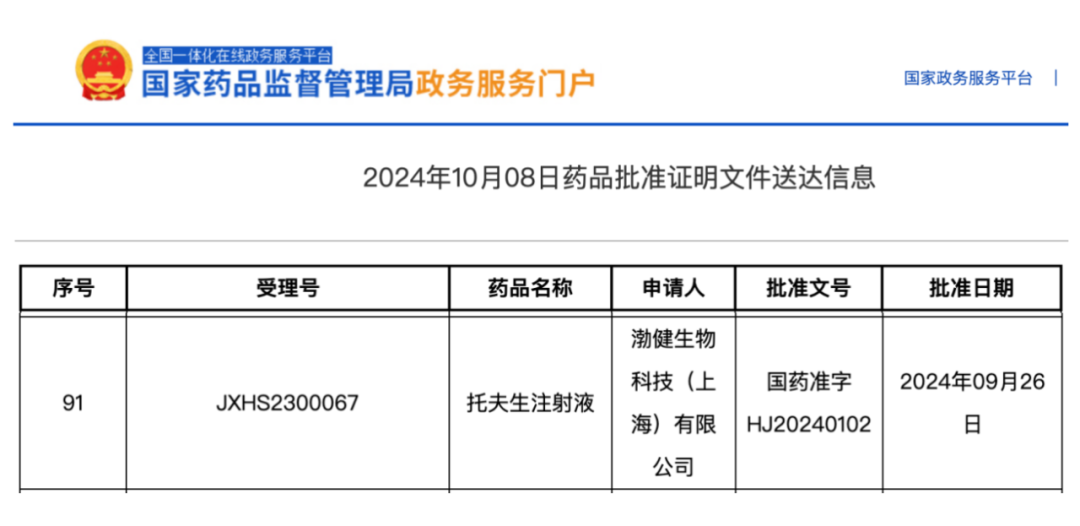
图源:国家药监局
这是全球首个渐冻症对因治疗药物。
公司发言人曾透露,托夫生每剂售价为 14,230 美元,第一年需使用 14 剂,总计 199,200 美元(约合人民币 140 万)。
无法治愈的渐冻症,如何寻找药物?
2014 年,一场火遍全球的「冰桶挑战赛」让人们了解了「渐冻症」。
这是一种进行性、致命的神经退行性疾病,影响大脑和脊髓的运动神经元,导致肌肉无力、瘫痪并最终死亡 [1]。
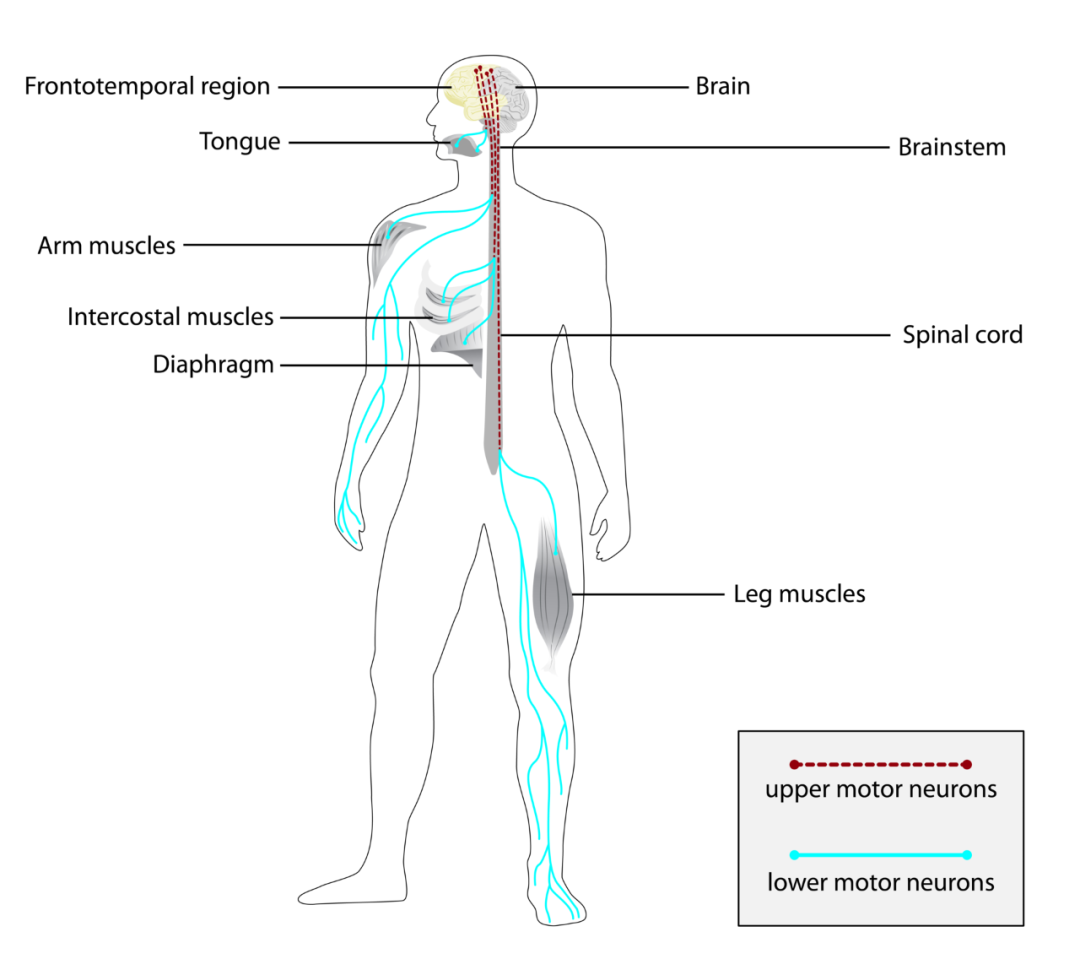
渐冻症通常影响上运动神经元、下运动神经元和大脑额颞区 图源:参考资料 2
在所有渐冻症患者中,约 90~95% 的病例病因不明(散发性),其余 5~10% 的病例则可能与遗传有关(家族性)。正因如此,目前渐冻症尚不能治愈,治疗目标以减缓病情进展和改善症状为主[2]。
相应地,药物的开发也主要以这两个治疗目标为导向。
最先被批准用于治疗渐冻症的药物是利鲁唑(Riluzole),可使患者存活时间延长 2~3 个月 [3]。另一种药物依达拉奉(Edaravone)则是一种抗氧化剂,它于 2017 年被美国 FDA 批准用于治疗渐冻症,大约对 5% 的患者有效 [4]。
此外,FDA 还于 2022 年批准了一款组合药 Relyvrio,由苯丁酸钠和牛磺酸熊二醇组成。然而,今年 3 月,Relyvrio 被撤回,因为最新的 III 期临床试验表明,这个药物对渐冻症并无明显益处 [5]。
上述药物,无论哪种,与「减缓病情进展」间的因果关系均不够明确,于是科学家们开始尝试从病因入手寻找突破。
全球首个对因药物,世界各地为它开绿灯
随着基因检测技术的快速发展,与渐冻症发病相关的基因逐渐被探明。截至目前,已发现超过 40 个基因与渐冻症相关,可解释大约 70% 的家族性渐冻症和大约 15% 的散发性渐冻症的病因 [2]。
渐冻症可能对发病机制及其相关基因 图源:参考资料 2
其中 4 个基因的相关性最为显著:C9orf72、SOD1、FUS 和 TARDBP [2]。针对这些基因的药物开发也逐步开展。
开头提到的托夫生就是一种 SOD1 基因靶向药物。
SOD1 基因突变会产生异常的毒性蛋白,当这些毒性蛋白不断积累,就会引起细胞功能障碍,导致渐冻症患者出现神经退化和肌肉无力。托夫生通过靶向突变 SOD1 基因产生的 mRNA,可有效减少毒性 SOD1 蛋白的合成 [1]。
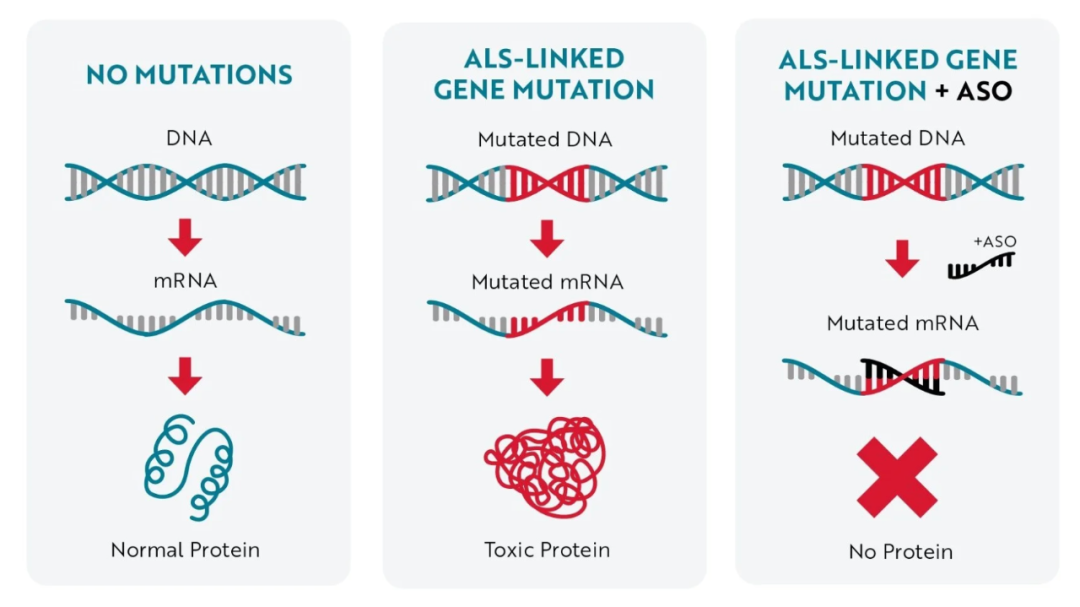
托夫生作用机制 图源:参考资料 6
作为全球首款对因治疗药物,托夫生的获批之路十分顺畅。
仅仅凭借显著降低血浆神经丝轻链 (NfL)的能力,2023 年 3 月,FDA 委员会的一致建议加速批准托夫生,不到一个月,托夫生正式获批。
NfL 是一种评估渐冻症进展的常用指标,被认为是神经元损伤的标志物。考虑到托夫生可显著降低 NfL,即使当时相关的 III 期临床试验并未完成,FDA 仍然以「药物被证明对替代终点有影响,该终点很可能预测患者临床获益」为理由,加速审批了托夫生[7]。
图源:FDA
今年 5 月,托夫生在欧盟获准用于医疗用途 [8]。
而在我国,今年 3 月 21 日,托夫生首先在瑞金海南医院应用于临床;不到 7 个月后的今天,托夫生正式在我国获批。

图源:上海交通大学医学院附属瑞金医院公众号
有争议,是件好事
值得注意的是,在中国临床试验注册中心官网以「托夫生」或其英文名称检索时发现,并无已注册的临床试验,这表明,托夫生在国内很可能是通过免临床途径获批上市。
图源:中国临床试验注册中心官网
而当一款药出生就带着众人瞩目,争议也不免放大。
争议 1:对大部分患者无效
伴随着获批的喜讯,一个事实是「托夫生对大部分渐冻症无效」。[1]
正如前文所提,只有 5~10% 的渐冻症可能与遗传有关,而发生 SOD1 基因突变的患者则不过总数的 2%。
争议 2:加速批准,依旧需要补充临床试验
FDA 加速批准也引发了不少争议。
不过这并非新闻。此前,可修正阿兹海默症(AD)发生过程的单抗药物 Aducanumab 也同样因为加速批准引发广泛讨论。
对比托夫生缺少完整的临床数据,同样来自渤健的 Aducanumab 的争议更大:两项 3 期试验结果相互矛盾,且临床获益不明确。(点击查看丁香园往期文章:全球首个延缓阿兹海默症进展新药获批上市,为何争议不断?)
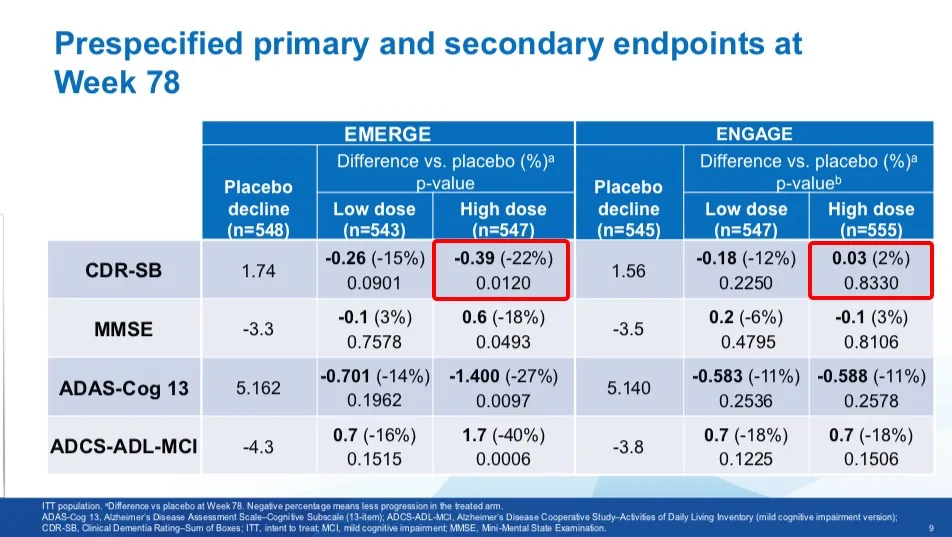
Aducanumab 相关的两项临床试验结果 图源:参考资料 9
但 FDA 最终还是以「Aducanumab 可使中枢神经系统 Aβ 负担减少」作为存在合理因果关系的可能替代终点,加速审批了这个药物。
对于某些严重疾病或未满足的医疗需求,FDA 允许以「替代终点」为依据(而非实际临床疗效)批准药物尽快上市。同时,这类审批相应的要求是,需要对药物继续进行以实际临床疗效为重点的新临床试验。如果后续的临床试验未能证明该药物的临床获益,FDA 有权撤销批准 [10]。
今年 1 月,渤健宣布停止 Aducanumab 的静脉注射液的开发和上市,并终止相关的临床研究,这个药物的「职业生涯」就此画上句号 [11](点击查看丁香园往期文章:凉凉!一年 35 万,作为全球首款上市两年后,这几天彻底退市了)。
图源:渤健(Biogen)
不过,对于这样的领域来说,能获批是好事,有争议,也是好事。
审批程序的设置,是基于对疾病的考量;而加速程序的设置,是对患者群体急迫用药的关怀。
正如一位 AD 患者协会首席科学官说的那样:「即使临床数据存在问题,但我们必须权衡科学标准与生活残酷的现实,至少让患者有一些尝试的希望,而不是让他们为了获得一些更加确定的积极结果,继续苦等数年。」[12]
托夫生能走多远,我们持续关注。
策划:肯德羊 | 监制:carollero
题图来源:everyone.org
参考资料:
[1]https://www.ncbi.nlm.nih.gov/books/NBK594270
[2]https://en.wikipedia.org/wiki/ALS
[3]https://en.wikipedia.org/wiki/Riluzole
[4]https://en.wikipedia.org/wiki/Edaravone
[5]https://en.wikipedia.org/wiki/Sodium_phenylbutyrate/ursodoxicoltaurine
[6]https://www.als.org/navigating-als/living-with-als/fda-approved-drugs/tofersen
[7]https://www.fda.gov/drugs/news-events-human-drugs/fda-approves-treatment-amyotrophic-lateral-sclerosis-associated-mutation-sod1-gene
[8]https://ec.europa.eu/health/documents/community-register/html/h1783.htm
[9]Biogen-ENMERGE and ENGAGE Topline Results: Two Phase 3 Studies to Evaluate Aducanumab in Patients With Early Alzheimer’s Disease
[10]https://www.fda.gov/drugs/nda-and-bla-approvals/accelerated-approval-program
[11]Biogen to Realign Resources for Alzheimer's Disease Franchise | Biogen
[12]The New York Times-F.D.A. Approves Alzheimer’s Drug Despite Fierce Debate Over Whether It Works
未经允许不得转载:澳鸟-全球资讯平台 » 全球首款!这个药刚刚国内获批,一年 140 万
 澳鸟-全球资讯平台
澳鸟-全球资讯平台









